RESSOURCES DIVERSES
Nous écrire à info@nutrition2c.com
pour ajouter d'autres ressources.
Voir FAQ (Questions-réponses)
Vous désirez connaître nos honoraires en cliquant ici.
_____________________________________________________
Additifs alimentaires autorisés (listes)
Additifs alimentaires bilingues (synonymes autorisés)
Additifs alimentaires (par ordre alphabétique)
Additifs alimentaires (E100 à E1522)
Allégations liées à la diminution de maladies
Allégations pour la santé
Allégations pour les probiotiques
Allergènes et liste d’ingrédients
Allergènes gluten et sulfite
Arbre de décision
Arrondissements TVN Canadiens (p. ex. 984,49 doit être arrondi à 984) (p. ex. 984,50 doit être arrondi à 985)
Code des couleurs Nutri-Score
Colorants alimentaires (liste par ordre alphabétique)
Conversion vitamine A, vitamine D, vitamine E, niacine, etc.
Critères santé d’aliments: écoles et autres
Déclaration obligatoire oméga, potassium, polyalcool, produit avec vitamine D
Étiquetage pour l’industrie alimentaire
Europe: CELEX loi
Europe - Règlement (UE) étiquetage nutritionnel
Étiquetage pour l’industrie alimentaires
Fibres alimentaires
Gabarits nouveaux modèles de tableaux TVN
Guide d’étiquetage pour l’industrie
Images de produits alimentaires canadiens
Ingrédients déclarés
Lait (autres noms) Allergènes
Liste d'ingrédients
Lois et drogues (en pdf)
Modifications canadiennes
NIH Unit Conversion
Paperless printer
PDF creator Gratuit
Portions de références (anciennes)
Portions ou quantités de références plus précises (déc. 2016)
Règlements sur aliments et drogues
Sucres alcool
Tableau détails des éléments nutritifs
Test de conformité
USDA Arrondissements et autres informations sur l'étiquetage Présentation (pdf)
USDA Food Labeling Guide for Industries
USDA Food Labeling
USDA Gabarits nouveaux modèles de tableaux included 8 g sugar added
USDA Gros document avec questions et réponses
USDA Liste d’ingrédients
USDA Nutrition Labeling (Janvier 2013 ancien)
USDA Portions de référence (Janvier 2017 NOUVEAU)
USDA Portions de référence (Nouveau)
USDA Présentation générale sur l'étiquetage nutritionnel
USDA Présentation générale sur l'étiquetage nutritionnel simple
USDA Valeurs quotidiennes (Janvier 2013 ancien)
Valeurs quotidiennes complètes (NOUVEAU)
Valeurs quotidiennes complètes (NOUVEAU : document plus beau)
Valeurs quotidiennes en % (pour public anciennes données)
Guide d’étiquetage pour l’industrie
_________________________________________________
Tableau détaillant les anciennes et nouvelles
données américaines et canadiennes
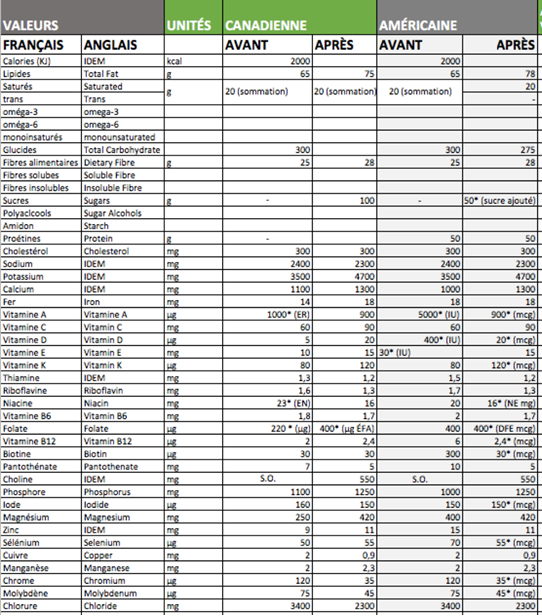

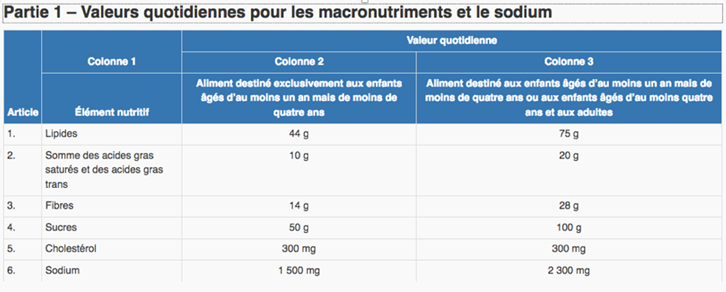
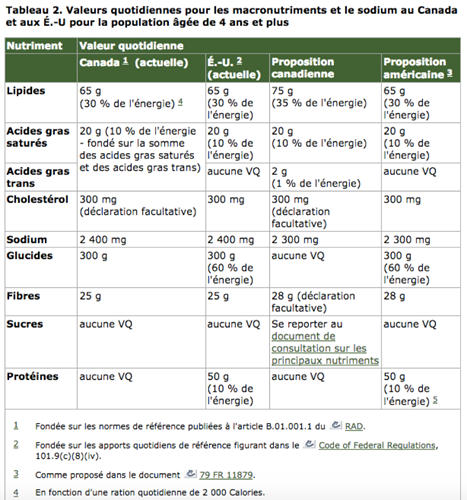
CANADA: NOUVELLES VALEURS DE BASE
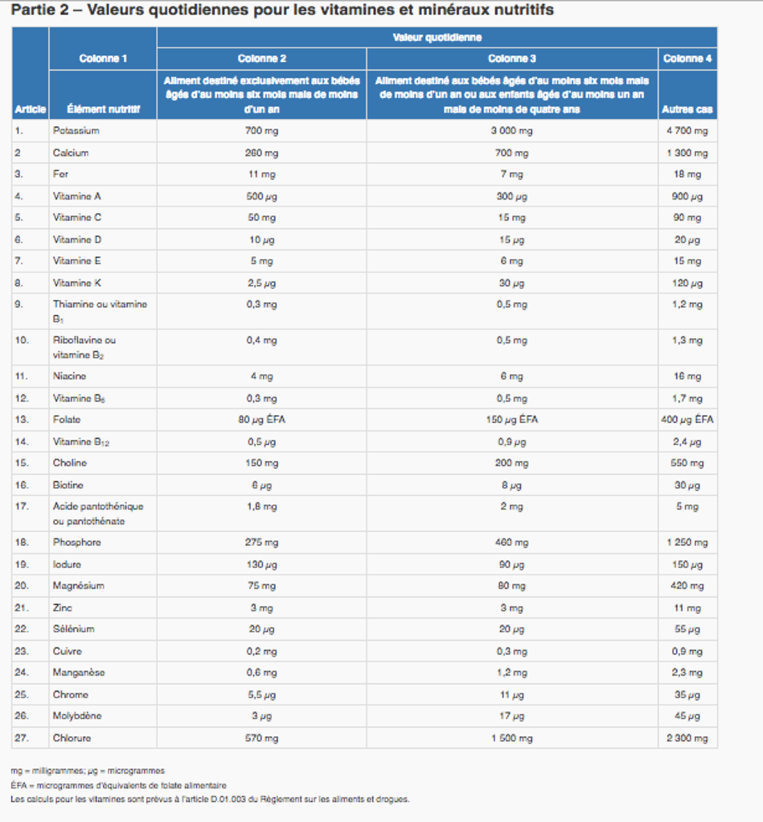
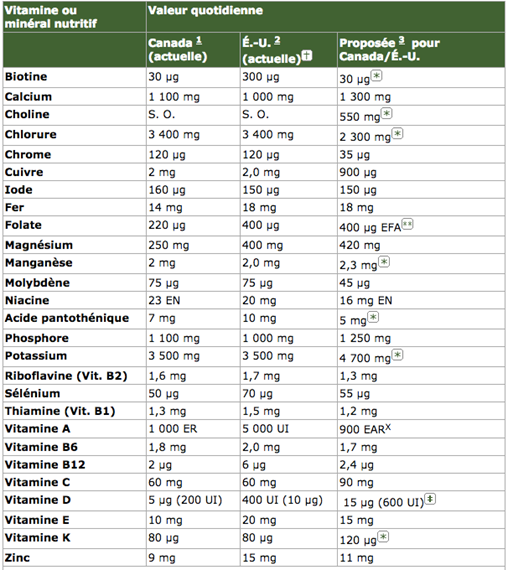
CANADA: VALEURS QUOTIDIENNES
(petits bébés, bébés, colonne 4 adultes)
CANADA: EXEMPLE DE TVN

CANADA: VISUEL DES CHANGEMENTS
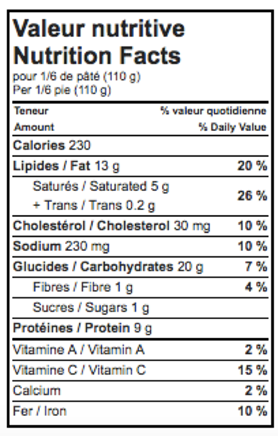
CANADA: ANCIENNES VALEURS DE BASE
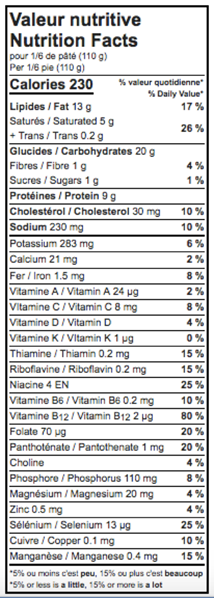
CANADA: ANCIENNES VALEURS VITAMINES ET MINÉRAUX
_______________________________________________________________________
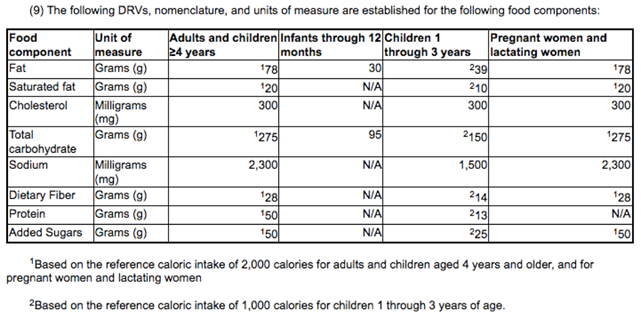
USDA: NOUVELLES VALEURS DE BASE
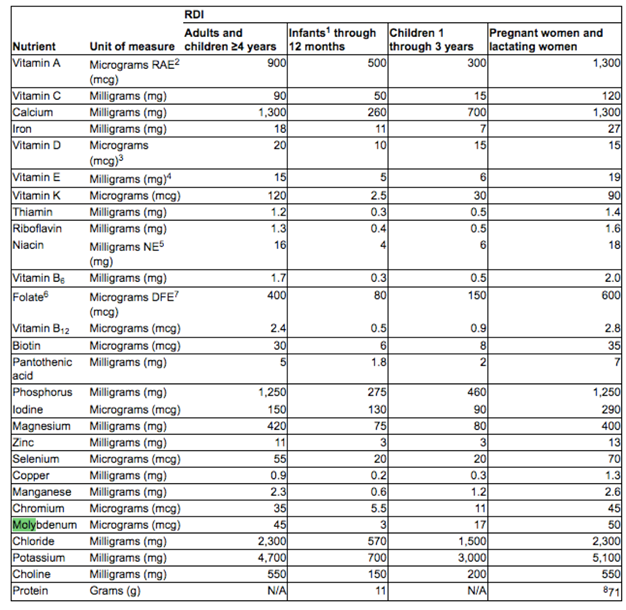
USDA: NOUVELLES VALEURS VITAMINES ET MINÉRAUX
USDA: EXEMPLE D'UN NOUVEAU TABLEAU
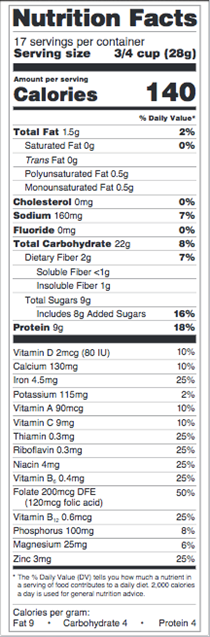
USDA: VISUEL DES CHANGEMENTS
USDA: ANCIENNES VALEURS VITAMINES ET MINÉRAUX
IMAGES DIVERSES



__________________________________________________________________
AUTRES INFORMATIONS PROVENANT DE
ACC LABEL

Rule Sizes
The lines may be used to measure leading (spacing between lines of text), as well as the thickness of lines in the Nutrition Facts table:
- The 0.25 point hairline rule is required in the
US Nutrition Facts table (NFT). - The 0.5 point thin rule is required for the
Canadian standard NFT. - The 1 point rule is required above Calories in the Canadian standard NFT.
- The 2 point rule is required in the Canadian standard NFT, below the serving size declaration and above the vitamin declaration.
- The 3 point rule may be used to measure the spacing required between the outer box outline of the Canadian NFT and the text enclosed.

Type height
in points
Type height for different point sizes of Helvetica® font (for uppercase and lowercase letters).
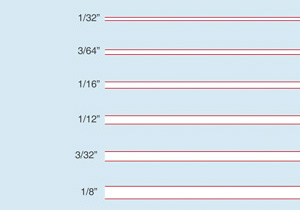
Type height
in mm and inches
Clear see through polymer allows to measure, between lines, type heights on printed material.
Measures shown in both millimetres and fractions of an inch.
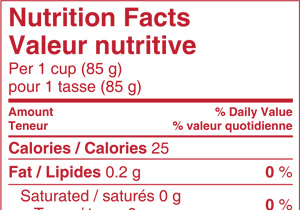
Canadian Bilingual Standard
Nutrition Facts Table
Model 3.1
By overlapping this Nutrition Facts table over the one on the printed label, one can easily verify whether all the typographical requirements are met.
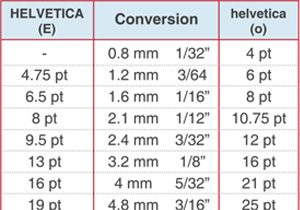
Conversion of Font Sizes
Conversion of Helvetica® font sizes in points versus mm and inches, for uppercase letters (left-hand column) and lowercase letters (right-hand column).
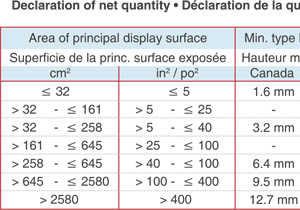
Type Height Requirements
Table of Canadian and USA minimum type requirements for the net quantity declarations, based on the packaging dimensions.
COORDONNÉES
CANADA
Centre opérationnel du Québec
2001, boulevard Robert-Bourassa
Pièce 671
Montréal (Québec)
H3A 3N2
Télé : 514-283-8888
Téléc : 514-283-3143
Bureaux régionaux du Québec
Montréal-Est
RME - 2001 boulevard Robert-Bourassa
Pièce 671
Montréal (Québec)
H3A 3N2
Télé : 514-283-8888
Téléc : 514-283-3143
Bureaux régionaux – Opérations Montréal-Est
Montréal-Ouest
RMO - 2001 boulevard Robert-Bourassa
Pièce 671
Montréal (Québec)
H3A 3N2
Télé : 514-283-8888
Téléc : 514-283-3143
Bureaux régionaux – Opérations Montréal-Ouest
Québec
Place Iberville IV
Pièce 100
2954, boulevard Laurier
Ste-Foy (Québec)
G1V 5C7
Télé : 418-648-7373
Téléc : 418-648-4792
Bureaux régionaux – Opérations Québec
St-Hyacinthe
Rachelle Massé, personne ressource
3225, avenue Cusson
Pièce 4500
Saint-Hyacinthe (Québec)
J2S 0H7
Télé : 450-768-1500
Téléc : 450-768-1473
Bureaux régionaux – Opérations St-Hyacinthe
Santé Canada: Fichier Canadien: Marie-France Verreault: 613-957-8049 marie.france.verreault@hc-sc.gc.ca
Santé Canada: Étiquette Marcia Leblanc: 613-948-7261 marcia.leblanc@hc-sc.gc.ca
Conversation ouverte. 1 message lu.
Aller au contenu
Utiliser Gmail avec un lecteur d'écran
Plus
Information modification règlementaire sur l'étiquetage- Règlement sur les aliments et drogues
- Modifications à l'étiquetage des aliments (https://www.canada.ca/fr/sante-canada/services/modifications-etiquetage-aliments.html#a3)
Plan de mise en œuvre des modifications au Règlement sur les aliments et drogues en matière d'étiquetage nutritionnel, de la liste des ingrédients et des colorants alimentaires
Le 14 décembre 2016, Santé Canada a publié, dans la Partie II de la gazette du Canada , des modifications au Règlement sur les aliments et drogues (Règlement) en matière d'étiquetage nutritionnel, de la liste des ingrédients et des colorants alimentaires. Les principaux changements sont liés :
- aux nouvelles exigences concernant la lisibilité de la liste des ingrédients;
- au regroupement des sucres dans la liste des ingrédients;
- aux divers changements aux renseignements contenus dans le tableau de la valeur nutritive (TVN);
- aux nouvelles exigences sur la façon dont on déclare la présence de colorants alimentaires;
- au retrait de l'exigence de certification des colorants synthétiques;
- à l'incorporation par renvoi des valeurs quotidiennes, modèles pour les formats du tableau de la valeur nutritive (TVN), quantités de référence, portions indiquées et de la majorité des spécifications pour les colorants alimentaires.
Ces modifications réglementaires offrent une période de transition de cinq (5) ans aux parties réglementées pour respecter les nouvelles exigences en matière d'étiquetage. Les modifications concernant les spécifications pour les colorants alimentaires et le retrait de l'exigence en matière de certification des colorants synthétiques entrent en vigueur immédiatement.
Ce document fournit un résumé du plan de mise en œuvre pluriannuel de l'ACIA et de Santé Canada pendant cette période de transition.
Pendant la période de transition de cinq (5) ans, les parties réglementées peuvent mettre en œuvre soit l'ancien ou le nouveau Règlement. Santé Canada et l'ACIA ont élaboré un plan de mise en œuvre pour cette période de transition qui comprend trois (3) phases. L'échéancier pour chaque phase sera défini à une date ultérieure et sera communiqué aux intervenants.
Les principales activités qui seront effectuées au cours de chaque phase sont résumées ci-après.
Phase I (présentement en cours)
La publication de ces modifications dans la Partie II de la Gazette du Canada marque le commencement de la phase I.
Principales activités :
- Outils et formation – L'ACIA mettra à jour ses lignes directrices et ses outils Web afin de refléter les exigences en vertu du nouveau Règlement, tout en maintenant les lignes directrices et les outils qui tiennent compte des exigences en vertu de l'ancien Règlement. Pendant la période de transition, il y aura donc deux ensembles de lignes directrices et d'outils qui seront accessibles sur le site Web de l'ACIA. L'ACIA élaborera et offrira une formation au personnel. Santé Canada offrira des webinaires techniques pour les intervenants externes et mettra à jour ses lignes directrices Web.
- Demandes de renseignements – Santé Canada répondra aux demandes concernant les nouvelles exigences et leur objectif. L'ACIA répondra aux demandes liées à la conformité et à l'application de la loi.
- Conformité et application de la loi – Les inspections de l'ACIA mettront l'accent sur la disponibilité (présence sur l'étiquette) et l'exactitude des renseignements obligatoires (telles que les valeurs déclarées dans le TVN, la validité des allégations et de la déclaration des ingrédients, y compris les allergènes), peu importe les exigences en matière d'étiquetage respectées par le fabricant, que ce soit les nouvelles ou les anciennes.. Santé Canada effectuera des évaluations des risques pour la santé en appui aux activités de conformité de l'ACIA en plus d'offrir des lignes directrices sur l'interprétation de ces modifications réglementaires.
Phase II
La phase II commencera lorsque la responsabilité de répondre aux demandes de renseignements concernant les nouvelles exigences passera de Santé Canada à l'ACIA et se poursuivra jusqu'à la fin de la période de transition.
Principales activités :
- Outils et formation – La formation et les outils libre-service seront mis à la disposition du personnel de l'ACIA pendant qu'il répond aux demandes de renseignements et effectue des inspections.
- Demandes de renseignements – Le rôle de Santé Canada sera de répondre aux questions concernant l'objectif du Règlement. L'ACIA s'occupera des demandes liées aux nouvelles exigences et à son approche en matière de conformité et d'application de la loi.
- Conformité et application de la loi – Les inspections de l'ACIA seront axées sur la disponibilité et l'exactitude des renseignements obligatoires, peu importe les exigences en matière d'étiquetage respectées par le fabricant, que ce soit les nouvelles ou les anciennes. Santé Canada effectuera des évaluations des risques pour la santé en appui des activités de conformité de l'ACIA et continuera d'offrir des lignes directrices sur l'interprétation de ces modifications réglementaires.
Phase III
La phase III commencera à la fin de la période de transition.
Principales activités :
- Outils et formation – Les lignes directrices et les outils de l'ACIA accessibles sur le site Web de l'Agence tiendront uniquement compte des exigences en vertu du nouveau Règlement. L'ACIA intégrera le contenu lié au nouveau Règlement dans la formation continue sur l'étiquetage, y compris la formation offerte au nouveau personnel.
- Demandes de renseignements – Le rôle de Santé Canada sera de répondre aux questions concernant l'objectif du Règlement. L'ACIA s'occupera des demandes liées aux nouvelles exigences et à son approche en matière de conformité et d'application de la loi.
- Conformité et application de la loi – Les inspections de l'ACIA assureront la conformité aux nouvelles exigences en matière d'étiquetage. Les renseignements présentés en conformité avec les anciennes exigences ne seront plus conformes. Santé Canada effectuera des évaluations des risques pour la santé en appui des activités de conformité de l'ACIA et continuera d'offrir des lignes directrices sur l'interprétation de ces modifications réglementaires.
Finalement le document intitulé Modèles à l'usage des concepteurs d'étiquettes : tableau de la valeur nutritive et liste des ingrédients a été révisé afin de refléter les nouvelles exigences réglementaires. Il est possible de le commander sur le site Web de Santé Canada.
Tel que mentionné, je vous invite à communiquer avec Santé Canada à l’adresse suivante si vous avez des questions supplémentaires : nut.labelling-etiquetage@hc-sc.gc.ca
Bonne journée à vous,
Catherine Jodoin
Superviseur intérimaire des agents régionaux
Direction générale des operations, Saint-Hyacinthe
Agence canadienne d'inspection des aliments / Gouvernement du Canada
Catherine.jodoin@inspection.gc.ca/ Tél. 450-768-1414 / Cell : 450-513-0565
Regional Officer – Acting supervisor
Operations Branch, St. Hyacinthe Region
Canadian food inspection agency, Government of Canada
Catherine.jodoin@inspection.gc.ca / Tel: 450-768-1414/ Mobile : 450-513-0565
3 pièces jointes
|
USDA
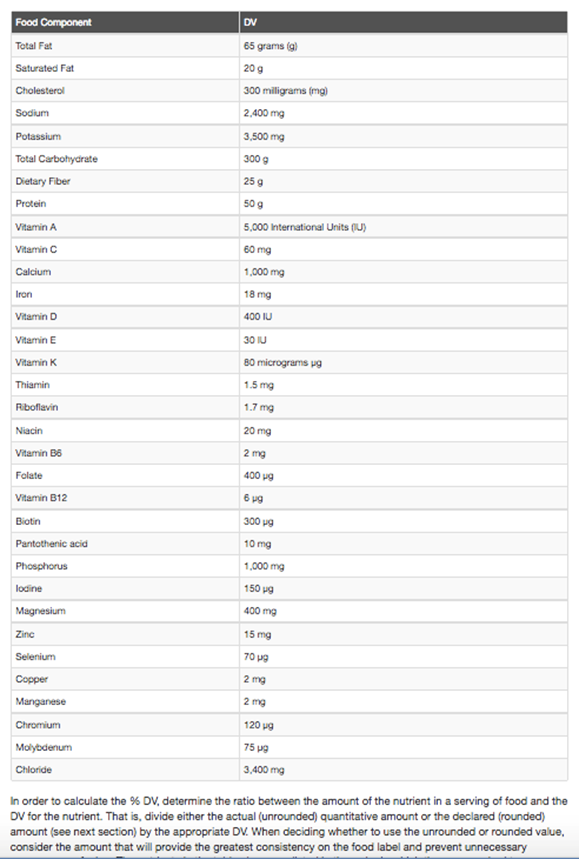
In order to calculate the % DV, determine the ratio between the amount of the nutrient in a serving of food and the DV for the nutrient. That is, divide either the actual (unrounded) quantitative amount or the declared (rounded) amount (see next section) by the appropriate DV. When deciding whether to use the unrounded or rounded value, consider the amount that will provide the greatest consistency on the food label and prevent unnecessary consumer confusion. The nutrients in the table above are listed in the order in which they are required to appear on a label in accordance with 21 CFR 101.9(c). This list includes only those nutrients for which a DRV has been established in 21 CFR 101.9(c)(9) or a RDI in 21 CFR 101.9(c)(8)(iv).
For questions regarding this document, contact the Center for Food Safety and Applied Nutrition (CFSAN) at 240-402-2371.